live longer and better.

live longer and better.
2014年12月

我們透過思路迪北京(我們的主要營運附屬公司之一)開始從事藥物發現及開發業務。
2016年
- 2016年2月,我們與康寧傑瑞集團就(其中包括)恩沃利單抗(KN035)於腫瘤適應症的共同開發及獨家商業化權利訂立協議;
- 2016年12月,我們自中國國家藥監局獲得恩沃利單抗的IND批准。
2017年

- 2017年2月,我們於美國進行恩沃利單抗首次人體I期試驗;
- 2017年3月,我們於中國進行恩沃利單抗I期試驗;
- 2017年10月,我們於日本進行恩沃利單抗I期試驗;
- 2017年11月,我們提出在全球申請3D011的PCT專利。
2018年

- 2018年4月,我們於中國進行恩沃利單抗治療晚期膽道癌(BTC)的隨機III期試驗;
- 2018年8月,我們於曾接受既往治療的MSI-H/dMMR晚期癌症患者中進行恩沃利單抗的關鍵II期試驗;
- 2018年9月 ,我們自海和藥物集團獲得全球專利,可在全球開發、製造、進口、使用、註冊、商業化及授出開發3D185用於治療腫瘤及肺纖維化的分許可;
- 2018年12月,我們啟動3D185的首次人體I期試驗。
2019年

- 2019年9月我們自FDA獲得3D185的IND批准;
- 2019年10月思路迪北京取得高新技術企業證書;
- 2019年12月我們與康寧傑瑞集團及TRACON訂立合作及臨床試驗協議,以在美國、加拿大、墨西哥及其各自屬地臨床開發及商業化恩沃利單抗用於治療肉瘤。
2020年1月
我們自FDA獲得恩沃利單抗治療晚期BTC的孤兒藥資格認定。
2020年3月

我們與康寧傑瑞集團及先聲藥業集團訂立三方合作協議,以 於中國生產、推廣及分銷恩沃利單抗
2020年10月

我們自海和藥物集團授權引進3D1001及3D1002於中國的開發、生產及商業化權利。
2020年11月

我們與Aravive Inc.訂立合作及許可協議,獲得於中國大陸、台灣地區、香港及澳門開發、製造及商業化用於診斷、治療及預防人類腫瘤疾病的含有3D229(作為唯一的原料藥)的產品的獨家許可。
2020年12月

- 我們提交的恩沃利單抗治療MSI-H/dMMR晚期實體瘤的BLA獲中國國家藥監局受理。
- 我們與SELLAS Life Sciences Group, Inc.(一家在納斯達克上市的公司)及其附屬公司(統稱「SELLAS」)訂立許可協議,就開發、生產及商業化3D189及3D059獲得SELLAS擁有及控制的若干知識產權的許可,用於中國大陸、香港、澳門及臺灣地區的所有療法及其他診斷。
- 我們與Y-Biologics就3D057的授權(亦稱為YBL-013,一種T細胞雙特異性受體)訂立一份許可協議,我們將據此獲得利用Y-Biologics的抗體相同細胞受體(ALiCE)平臺技術於治療、緩和、預防及診斷應用等所有治療領域在中國、香港、澳門及臺灣地區開發、生產及商業化3D057的獨家權利。
2021年1月
- 我們自中國國家藥監局獲得3D011的IND批准;
- 中國國家藥監局公佈我們的恩沃利單抗獲納入優先審評。
2021年3月

- 我們於中國提交3D229的IND。
- 我們與ImmuneOncia Therapeutics, Inc.訂立許可協議,獲得在中國內地、香港、澳門及台灣地區開發、製造及商業化3D197(亦稱為IMC-002)用於治療腫瘤適應症的獨家許可。
2021年4月
我們就在PROC患者中進行3D229的III期臨床試驗在中國提交IND申請,以參與MRCT。
2021年5月

- 我們獲中國國家藥監局批准啟動3D229的臨床試驗。
- 恩沃利單抗的首次人體研究發表在《The Oncologist》雜誌
2021年6月

恩沃利單抗的II期關鍵臨床試驗結果發表在《血液學與腫瘤學雜誌》上。
2021年11月
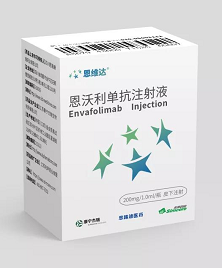
恩沃利單抗注射液在中國獲批上市,用於治療既往接受過治療的MSI-H/dMMR晚期實體瘤
2022年4月
恩維達®寫入2022版CSCO三大指南,包括:
1、《CSCO胃癌診療指南2022版》(Ⅰ級推薦,2A類證據)
2、《CSCO結直腸癌診療指南2022版》(Ⅱ級推薦,2A類證據)
3、《CSCO免疫檢查點抑制劑臨床應用指南2022版》(I級推薦,2A類證據)
2022年8月

恩維達®新增“300mg每兩周給藥一次”的用法用量方案,獲國家藥品監督管理局(NMPA)批准。
2022年10月
恩維達®寫入2022版《CSCO子宮內膜癌診療指南》 和 《CSCO宮頸癌診療指南》,成為高度微衛星不穩定/錯配修復功能缺陷(MSI-H/dMMR)的復發和轉移性子宮內膜癌、及復發和轉移性宮頸癌二線治療推薦用藥。
2022年10月
3D185獲得治療膽道癌的孤兒藥資格認定。
2022年11月
恩維達® (Envafolimab,皮下注射PD-L1)於中國,美國及日本開展的三項針對晚期難治實體瘤患者的I期臨床試驗數據結果。
恩維達® (Envafolimab,皮下注射PD-L1)治療MSI-H/dMMR晚期實體瘤受試者隨訪26.8個月的數據更新與亞組分析在CSCO上進行會上報告。
2022年12月

公司於香港聯交所正式掛牌上市,公司簡稱:3D Medicines,股票代碼:1244.HK。
2022年12月
恩維達®(Envafolimab,皮下注射PD-L1)獲得美國食品藥品監督管理局(「FDA」)的新藥臨床試驗(「IND」)同意進行治療錯配修復功能缺陷(「dMMR」)晚期實體瘤適應症的II期臨床試驗的正式通知。
2023年4月

公佈2022年年度報告,首個商業化產品恩維達®銷售額達5.67億元人民幣。
2023年8月

與翊斯生物達成合作開發協議,共同開發下一代mRNA腫瘤疫苗
2023年8月
恩維達®針對非小細胞肺癌患者的新輔助/輔助治療的III期臨床研究已獲得國家藥品監督管理局的臨床試驗許可
2023年8月

思路迪生物醫藥(上海)有限公司被認定為2023年上海市第二批“專精特新”中小企業
2024年3月

一圖讀懂|思路迪醫藥2023年度業績發佈

我們透過思路迪北京(我們的主要營運附屬公司之一)開始從事藥物發現及開發業務。

- 2016年2月,我們與康寧傑瑞集團就(其中包括)恩沃利單抗(KN035)於腫瘤適應症的共同開發及獨家商業化權利訂立協議;
- 2016年12月,我們自中國國家藥監局獲得恩沃利單抗的IND批准。

- 2017年2月,我們於美國進行恩沃利單抗首次人體I期試驗;
- 2017年3月,我們於中國進行恩沃利單抗I期試驗;
- 2017年10月,我們於日本進行恩沃利單抗I期試驗;
- 2017年11月,我們提出在全球申請3D011的PCT專利。

- 2018年4月,我們於中國進行恩沃利單抗治療晚期膽道癌(BTC)的隨機III期試驗;
- 2018年8月,我們於曾接受既往治療的MSI-H/dMMR晚期癌症患者中進行恩沃利單抗的關鍵II期試驗;
- 2018年9月 ,我們自海和藥物集團獲得全球專利,可在全球開發、製造、進口、使用、註冊、商業化及授出開發3D185用於治療腫瘤及肺纖維化的分許可;
- 2018年12月,我們啟動3D185的首次人體I期試驗。

- 2019年9月我們自FDA獲得3D185的IND批准;
- 2019年10月思路迪北京取得高新技術企業證書;
- 2019年12月我們與康寧傑瑞集團及TRACON訂立合作及臨床試驗協議,以在美國、加拿大、墨西哥及其各自屬地臨床開發及商業化恩沃利單抗用於治療肉瘤。

我們自FDA獲得恩沃利單抗治療晚期BTC的孤兒藥資格認定。

我們與康寧傑瑞集團及先聲藥業集團訂立三方合作協議,以 於中國生產、推廣及分銷恩沃利單抗

我們自海和藥物集團授權引進3D1001及3D1002於中國的開發、生產及商業化權利。

我們與Aravive Inc.訂立合作及許可協議,獲得於中國大陸、台灣地區、香港及澳門開發、製造及商業化用於診斷、治療及預防人類腫瘤疾病的含有3D229(作為唯一的原料藥)的產品的獨家許可。

- 我們提交的恩沃利單抗治療MSI-H/dMMR晚期實體瘤的BLA獲中國國家藥監局受理。
- 我們與SELLAS Life Sciences Group, Inc.(一家在納斯達克上市的公司)及其附屬公司(統稱「SELLAS」)訂立許可協議,就開發、生產及商業化3D189及3D059獲得SELLAS擁有及控制的若干知識產權的許可,用於中國大陸、香港、澳門及臺灣地區的所有療法及其他診斷。
- 我們與Y-Biologics就3D057的授權(亦稱為YBL-013,一種T細胞雙特異性受體)訂立一份許可協議,我們將據此獲得利用Y-Biologics的抗體相同細胞受體(ALiCE)平臺技術於治療、緩和、預防及診斷應用等所有治療領域在中國、香港、澳門及臺灣地區開發、生產及商業化3D057的獨家權利。

- 我們自中國國家藥監局獲得3D011的IND批准;
- 中國國家藥監局公佈我們的恩沃利單抗獲納入優先審評。

- 我們於中國提交3D229的IND。
- 我們與ImmuneOncia Therapeutics, Inc.訂立許可協議,獲得在中國內地、香港、澳門及台灣地區開發、製造及商業化3D197(亦稱為IMC-002)用於治療腫瘤適應症的獨家許可。

我們就在PROC患者中進行3D229的III期臨床試驗在中國提交IND申請,以參與MRCT。

- 我們獲中國國家藥監局批准啟動3D229的臨床試驗。
- 恩沃利單抗的首次人體研究發表在《The Oncologist》雜誌

恩沃利單抗的II期關鍵臨床試驗結果發表在《血液學與腫瘤學雜誌》上。

恩沃利單抗注射液在中國獲批上市,用於治療既往接受過治療的MSI-H/dMMR晚期實體瘤

恩維達®寫入2022版CSCO三大指南,包括:
1、《CSCO胃癌診療指南2022版》(Ⅰ級推薦,2A類證據)
2、《CSCO結直腸癌診療指南2022版》(Ⅱ級推薦,2A類證據)
3、《CSCO免疫檢查點抑制劑臨床應用指南2022版》(I級推薦,2A類證據)

恩維達®新增“300mg每兩周給藥一次”的用法用量方案,獲國家藥品監督管理局(NMPA)批准。

恩維達®寫入2022版《CSCO子宮內膜癌診療指南》 和 《CSCO宮頸癌診療指南》,成為高度微衛星不穩定/錯配修復功能缺陷(MSI-H/dMMR)的復發和轉移性子宮內膜癌、及復發和轉移性宮頸癌二線治療推薦用藥。

3D185獲得治療膽道癌的孤兒藥資格認定。

恩維達® (Envafolimab,皮下注射PD-L1)於中國,美國及日本開展的三項針對晚期難治實體瘤患者的I期臨床試驗數據結果。
恩維達® (Envafolimab,皮下注射PD-L1)治療MSI-H/dMMR晚期實體瘤受試者隨訪26.8個月的數據更新與亞組分析在CSCO上進行會上報告。

公司於香港聯交所正式掛牌上市,公司簡稱:3D Medicines,股票代碼:1244.HK。

恩維達®(Envafolimab,皮下注射PD-L1)獲得美國食品藥品監督管理局(「FDA」)的新藥臨床試驗(「IND」)同意進行治療錯配修復功能缺陷(「dMMR」)晚期實體瘤適應症的II期臨床試驗的正式通知。

公佈2022年年度報告,首個商業化產品恩維達®銷售額達5.67億元人民幣。

與翊斯生物達成合作開發協議,共同開發下一代mRNA腫瘤疫苗

恩維達®針對非小細胞肺癌患者的新輔助/輔助治療的III期臨床研究已獲得國家藥品監督管理局的臨床試驗許可

思路迪生物醫藥(上海)有限公司被認定為2023年上海市第二批“專精特新”中小企業

一圖讀懂|思路迪醫藥2023年度業績發佈