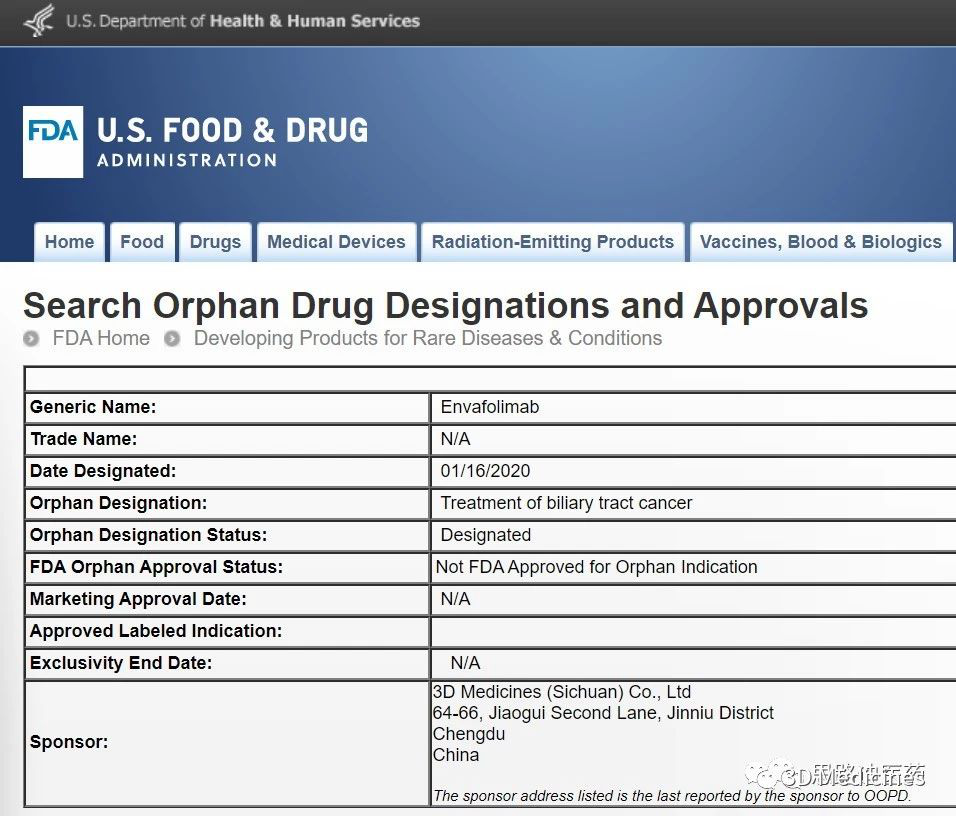
KN035(Envafolimab)被FDA授予孤兒藥資格
2020年1月18日,思路迪醫藥(以下簡稱“3D Medicines”或“思路迪”)與康寧傑瑞生物製藥(股票代碼:9966.HK)(以下簡稱“康寧傑瑞”或“公司”)聯合宣佈,美國食品和藥物管理局(FDA)已授予KN035(envafolimab)孤兒藥資格(Orphan DrugDesignation,ODD),用於治療膽道癌。
美國FDA“孤兒藥資格認定”源自《孤兒藥法案》(Orphan Drug Act,ODA),是FDA鼓勵開發在美國患病人數低於20萬疾病的創新藥措施。凡獲得孤兒藥資格認定的新藥,有機會獲得7年市場獨佔權。除此之外,FDA對孤兒藥還有稅費優惠、减免處方藥使用者費用、研發資助和方案協助、快速審批通道等一系列的配套措施。2018年,FDA全年準予的59種新藥中有34種是孤兒藥,而銷售額前十的癌症藥物裏,有8種在美國獲得了部分適應症的孤兒藥資格認定。銷售額最高的,治療多發性骨髓瘤的來那度胺,更是全部三項適應症都有“孤兒藥光環”。
思路迪醫藥董事長兼首席執行官龔兆龍博士提出,“美國FDA授予Envafolimab孤兒藥資格,對缺乏有效治療手段的膽道癌患者是一大福音。Envafolimab作為針對膽道癌一線治療的三期隨機對照研究,瞄準未被滿足的臨床需求,在國內外都具有創新性。該試驗由革命军東部戰區總醫院全軍腫瘤中心秦叔逵教授領導,現時進展順利。KN035作為皮下注射PD-L1/PD-(L)1抗體新藥,在改善腫瘤病人生活品質方面具有差异化優勢。開發工作從開始一直是針對全球市場佈局,第一個患者入組(FIH)在美國,陸續與FDA有很多科學上的溝通,2019年完成End-of-Phase II會議,為開展更多有價值的適應症做好準備。中國市場我們已經進入衝刺階段,作為第一個拿到國產PD-(L)1臨床批件的企業,我們希望國內腫瘤患者更快用上我們的產品,同時也希望為全球腫瘤患者提供更好的用藥選擇。”
康寧傑瑞創始人、董事長兼總裁徐霆博士表示:“KN035是康寧傑瑞自主研發的可採用皮下注射給藥的PD-(L)1抗體,與已經上市和在研的PD-(L)1抗體相比有明顯的差异化優勢。公司與思路迪醫藥合作進行聯合開發,已進入臨床後期開發階段。此次美國FDA孤兒藥資格認定是KN035全球戰畧佈局的一個重要進展,我們相信,它將為全球膽道癌患者帶來意義重大的治療選擇。”
關於KN035
KN035是PD-(L)1單域抗體與常規抗體Fc的融合蛋白,基於此獨特設計,在安全性、方便性、依從性方面具有優勢,可用於不適合靜脈輸液的患者,同時具有較低的醫療成本。現時在中國、美國和日本針對多個腫瘤適應症同步開展臨床試驗,部分適應症已進入Ⅲ期臨床。
關於思路迪醫藥
思路迪醫藥致力於開發具有差异化的腫瘤免疫治療藥物,延長腫瘤患者的生存時間,改善患者生活品質。公司現階段管線包括兩個臨床階段候選藥物:皮下注射PD-(L)1抗體KN035(2017年FDA/NMPA/PMDA獲准開展臨床研究);高選擇性FGFR-1/2/3抑制劑3D-185(思路迪醫藥擁有腫瘤和肺纖維化領域的全球開發權)。KN035全球共計六項臨床試驗在美、中、日同步進行,兩項關鍵注册臨床研究在中國開展,首個適應症預計2020年提交上市申報。思路迪醫藥已經擁有一支國際化的新藥開發團隊,有能力在全球同步開展臨床試驗和上市申報。
關於康寧傑瑞生物製藥
康寧傑瑞生物製藥是一家專注於研發、生產和商業化創新抗腫瘤生物大分子藥物的生物製藥公司。2019年12月12日,公司在香港聯合交易所主機板上市,股票代碼:9966。康寧傑瑞生物製藥在雙特异性抗體及蛋白質工程方面擁有全面整合的研發和製造平臺。公司高度差异化的產品管線由八種腫瘤候選藥物組成,其中6個為全球領先的雙功能抗體,四個產品在中國,美國,日本處於Ⅰ-Ⅲ期臨床試驗開發階段。公司擁有异二聚體及混合抗體等多個具有自主知識產權的科技平臺,以及成熟的符合中國,美國和歐盟cGMP的大規模生產能力。公司基於這些國際領先的蛋白質工程平臺打造多功能生物大分子新藥,惠及中國和全球的患者。
熱門文章

請諮詢我們