AXL抑製劑抗體新藥臨床試驗申請獲CDE受理
2021年3月6日,思路迪醫藥(3D Medicines Inc.)宣布,AXL抑製劑(GAS6餌蛋白融合蛋白)3D229注射液的臨床試驗申請已於日前獲國家藥品監督管理局藥品審評中心(CDE )正式受理,受理號為CXSL2100078,這是該類產品在國內的首個臨床申報。 3D229(又名:AVB-500)系美國Aravive公司的核心抗癌品種,2020年11月11日,思路迪醫藥從Aravive處獲得該品種在大中華區腫瘤領域的開發及商業化的獨家授權。 3D229注射液臨床試驗申請正式獲得受理,標誌著思路迪醫藥在順應腫瘤慢病化趨勢、構建差異化優勢和極具市場競爭力的產品佈局的道路上又邁出了堅實一步。
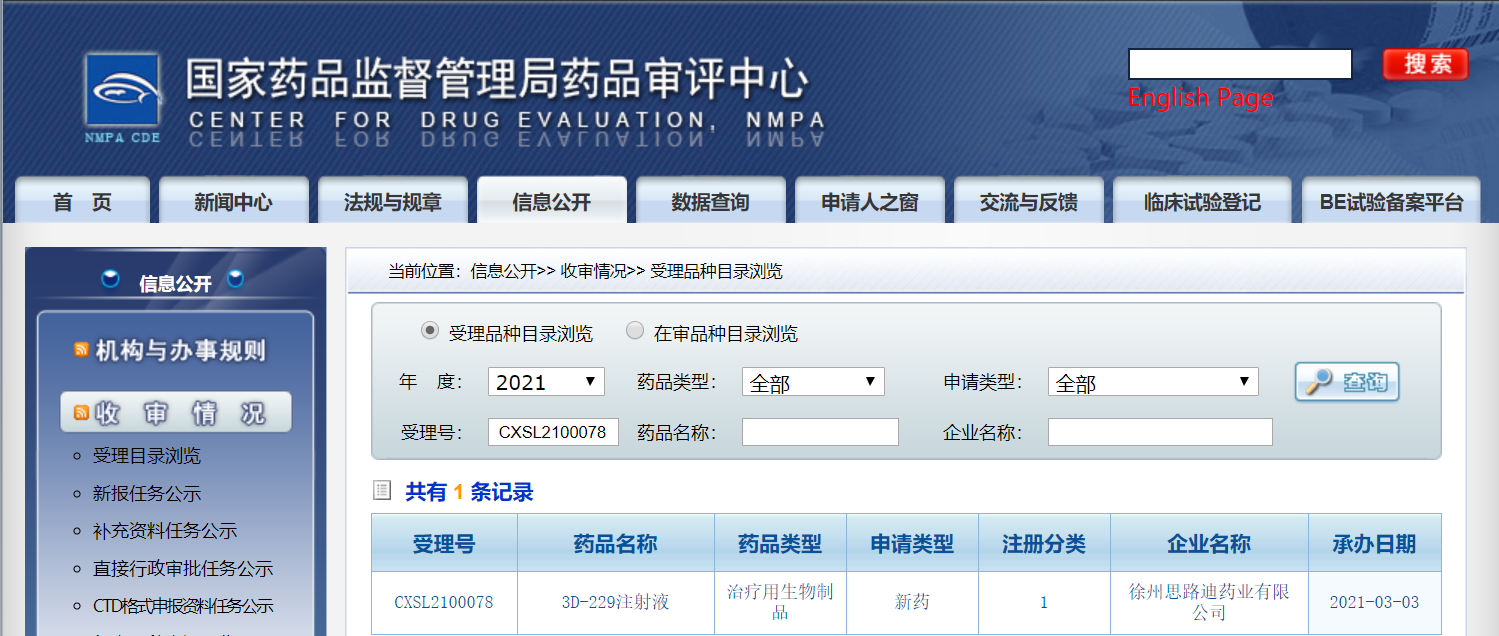
3D229注射液臨床試驗申請受理信息
3D229是特異性針對GAS6的高親和力Fc融合蛋白,也是一種新型GAS6-AXL信號通路抑製劑。 GAS6-AXL信號通路是促進腫瘤生長及轉移、腫瘤免疫逃逸與藥物耐受的關鍵通路。 AXL及其配體GAS6在許多惡性腫瘤中都有高表達和活化:如急性髓系白血病(AML),腎癌,胰腺癌,乳腺癌,肺癌,卵巢癌以及前列腺癌等。 GAS6-AXL信號通路抑製劑與免疫治療檢查點抑製劑、放療或化療的聯用均可實現對腫瘤的良好控制,因此,GAS6-AXL信號通路是當前腫瘤治療領域的重要突破口之一,可望成為與PD-1/L1聯用的重磅藥物,具有極高臨床價值和巨大市場空間。
自2020年10月以來,思路迪醫藥先後引進了包括3D229在內的5款創新藥產品,加速擴充其在研管線,目前已初步形成了以腫瘤免疫治療創新藥為核心、疼痛管理藥物為輔助的全方位管線佈局。 2020年11月11日獲得3D229在大中華區腫瘤領域的臨床開發及商業化的獨家授權之後,思路迪醫藥更是全力推進3D229臨床研究試驗的各項申報準備工作;僅花了不到四個月時間就完成了從項目引進到臨床試驗申請獲得受理的全過程,思路迪醫藥團隊對於抗腫瘤創新藥發展方向的精準把握能力以及對於引進項目的快速轉化能力再一次得到完美體現。
思路迪醫藥董事長兼首席執行官龔兆龍博士表示:“繼皮下注射PD-L1抗體新藥恩沃利單抗(Envafolimab)注射液上市申請被納入優先審評、公司首個自主研發藥物3D011臨床試驗獲批之後,我們非常高興看到3D229臨床試驗申請獲得正式受理,開創了國內同靶點藥物申報臨床的先河。思路迪醫藥會進一步推進腫瘤免疫治療藥物的研發,為全球腫瘤患者提供更多更優的治療選擇,幫助腫瘤患者活得更久更好。”
關於思路迪醫藥
思路迪醫藥是一家處於晚期臨床開發及早期商業化佈局階段的生物醫藥公司,秉承“幫助腫瘤患者活得更久更好”的理念,針對腫瘤治療慢病化的未來趨勢,專注為全球癌症患者開發差異化的腫瘤免疫治療藥物,延長腫瘤患者的生存時間,改善患者生活品質。公司產品線包括生物大分子藥物和小分子化學藥物,並擁有一支具有國際化新藥研發、註冊和商業化運營能力的團隊。
更多信息請訪問:
http://www.3d-medicines.com
思路迪醫藥前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,於作出前瞻性陳述當日之後,無論是否出現新資料、未來事件或其他情況,我們並無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,並理解我們的實際未來業績或表現可能與預期有重大差異。本文內所有關於或引用的本公司及董事的陳述、觀點或意願乃本文章刊發日期作出,可能因未來發展而出現變動。
熱門文章

請諮詢我們