思路迪醫藥皮下注射PD-L1抗體KN035的臨床試驗數據在2019年CSCO學術年會發布
2019年9月19日,思路迪醫藥參與第22屆全國臨床腫瘤學大會暨2019年CSCO學術年會,並由日本國立腫瘤研究所中央醫院Toshio Shimizu教授口頭報導了思路迪醫藥皮下注射抗PD- L1單域抗體Envafolimab (KN035)在日本晚期實體瘤患者中的1期臨床試驗(NCT03248843)階段性數據,具體展示信息如下:
口頭報導
論文題目:Phase I Study of Envafolimab (KN035), the First Subcutaneously Administered, Novel Fusion Anti-PD-L1 Antibody in Japanese Patients with Advanced Solid Tumors
講者:Toshio Shimizu, M.D., PhD.
時間:2019年9月19日(16:25-16:35)
地點:抗腫瘤藥物安全管理專場Session 3 2層 國宴3廳 廈門國際會議中心

以下為本次數據發布的詳細信息:
研究背景
Envafolimab (KN035)是我國自主研發,全球首個人源化抗PD-L1單域抗體和人IgG1 Fc的新型融合蛋白,與目前已經上市和在研的PD-1/PD-L1抗體相比有明顯的差異化的優勢。 Envafolimab具有可皮下注射、室溫下穩定、腫瘤穿透速度快等優點,從而提高腫瘤患者用藥依從性,改善患者生活質量,符合未來將腫瘤作為慢性病長期管理的趨勢。目前為止,Envafolimab在美國、日本和中國同步I期臨床試驗進展順利,在多線治療失敗的實體瘤患者中表現出良好的安全性及初步療效。
本次CSCO會議上,我們公佈的是一項在日本開展的針對晚期實體瘤患者的I期、開放性的劑量遞增和劑量擴展研究,旨在評估Envafolimab的安全性、耐受性、藥代動力學(PK)特徵和初步抗腫瘤療效。
研究方案及數據概述
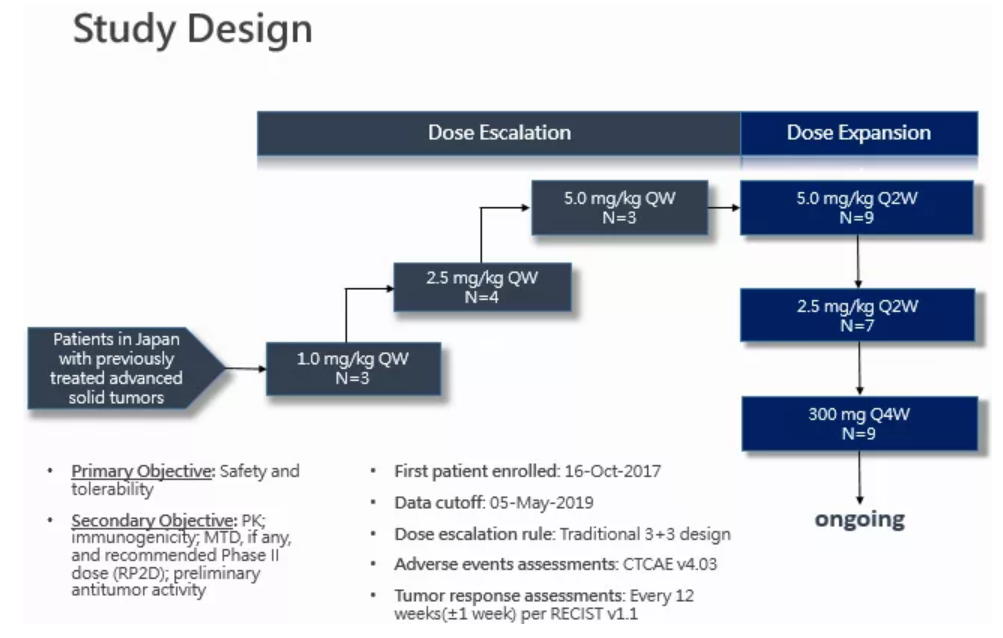
該項研究為評估皮下注射Envafolimab單藥治療日本晚期實體瘤患者安全性、耐受性、藥代動力學特徵和初步療效的劑量遞增和劑量擴展I期臨床研究。主要納入標準為經組織學或細胞學確認的晚期實體瘤、經標準治療失敗或不可耐受、不適合手術及局部治療、ECOG 0-1分、有足夠的造血和器官功能。
劑量遞增階段設計為傳統“3+3”劑量爬坡試驗,給藥劑量分別為1.0, 2.5, 5.0 mg/kg,每週一次(QW),皮下注射,劑量限制性毒性(DLT)觀察期在第一周期(首次給藥後28天內),劑量爬坡將持續到出現最大耐受劑量(MTD),並確定後期臨床試驗推薦劑量。劑量擴展階段分為2.5, 5.0 mg/kg,每兩週一次(Q2W),以及300mg 固定劑量,每四周一次(Q4W),皮下注射,將進一步在局部晚期或轉移性實體瘤患者中探索安全性、PK和初步療效。 300 mg 固定劑量組正在入組,暫無結果。
首例受試者於2017年10月16日接受首次給藥,截至2019年5月5日,該試驗共入組26例晚期實體瘤患者(劑量遞增階段10例,劑量擴展階段16例),包括4例膽道癌、3例軟組織肉瘤、2例尿路上皮癌、2例卵巢癌、2例結腸癌、2例胰腺癌和11例其它晚期實體瘤患者。患者中位年齡59歲,男性佔42.3%,接受過二線及以上治療的患者佔88.5%。至數據截止日期,有23例患者已退出研究(21例因疾病進展退出),有3例仍在繼續用藥。試驗使用實體瘤療效評價標準1.1版(RECIST v1.1)評價臨床療效,每12週評價一次,共12例患者接受過至少一次的基線後腫瘤療效評價。
研究結果
安全性結果
各劑量組均未觀察到劑量限制性毒性,且未達到最大耐受劑量。
不論與藥物的相關性和嚴重程度,最常見的不良事件有:發熱(19.2%)、淋巴細胞計數降低(15.4%)、皮膚瘙癢(15.4%)、皮疹(15.4%)、頭痛(15.4%) 、嘔吐(11.5%)。被認為與研究藥物相關的最常見不良事件有:發熱(11.5%)、皮膚瘙癢(11.5%)和皮疹(11.5%),均為1-2級。沒有患者發生5級藥物相關不良事件。有1例5.0 mg/kg Q2W劑量組患者發生3級藥物相關嚴重不良事件(腦梗塞,可能相關);1例2.5 mg/kg Q2W劑量組患者發生2級藥物相關嚴重不良事件(皮疹,已緩解),經研究者判斷為免疫介導的不良反應。
總體上,從目前日本1期的安全性數據看,Envafolimab的安全性可控。
初步有效性結果
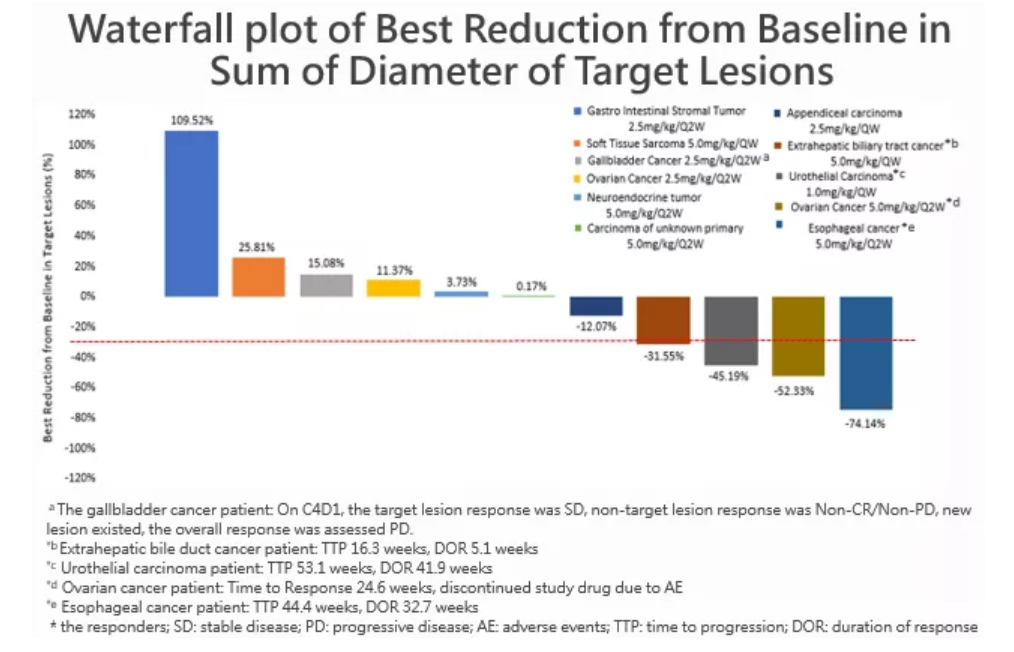
截至2019年5月5日,在12例接受療效評估的患者中(如下圖,瀑布圖中共11例,有1例基線時無靶病灶),4例患者觀察到最佳療效為部分緩解(PR ),其中3例(25.0%)經過療效確認,所有PR患者包括1例食管癌、1例卵巢癌均來自5.0mg/kg Q2W劑量組,食管癌疾病進展時間(TTP)44.4週、緩解持續時間(DOR)32.7週,卵巢癌腫瘤響應時間(TTR)24.6週,因不良事件退出研究;1例尿路上皮癌來自1.0 mg/kg QW劑量組,TTP 53.1週、DOR 41.9週;1例肝外膽管癌(未經療效確認)來自5.0 mg/kg QW劑量組,TTP 16.3週、DOR 5.1週。這4例PR,除上述卵巢癌患者外,均在用藥後12週第一次療效評估時出現了明顯的腫瘤退縮。
5例(41.7%)患者觀察到最佳療效為疾病穩定(SD),包括1例尿路上皮癌來自1.0 mg/kg QW劑量組(基線時無靶病灶,研究者評價最佳療效為SD) ,已完成19個週期的治療,至數據截止日期,該患者仍在接受治療;1例闌尾癌來自2.5 mg/kg QW劑量組,1例卵巢癌來自2.5 mg/kg Q2W劑量組,1例神經內分泌腫瘤、1例來源不明惡性腫瘤均來自5.0 mg/kg Q2W劑量組,這4例患者SD中位持續時間為11.5週。
本研究的受試者多數都經過了2線及以上治療,治療選擇很少,預後較差,在這些未經生物標記物選擇的晚期實體瘤患者中,給予Envafolimab單藥治療,在療效可評估人群的總體客觀緩解率(ORR)為25.0%,疾病控制率(DCR)達到66.7%,顯示了較好的臨床療效,在部分患者中看到了對治療產生了持久的高反應性,表明Envafolimab可能提供了一種新的、有前景的治療選擇。
藥代動力學特徵
初步PK分析表明(如下圖),Envafolimab有很好的穩定性,半衰期較長,支持後續臨床試驗採用較少頻次的給藥方案。不管是QW還是Q2W給藥方案,Envafolimab的體內暴露量與劑量表現出了良好的相關性,隨劑量的增加而增大。
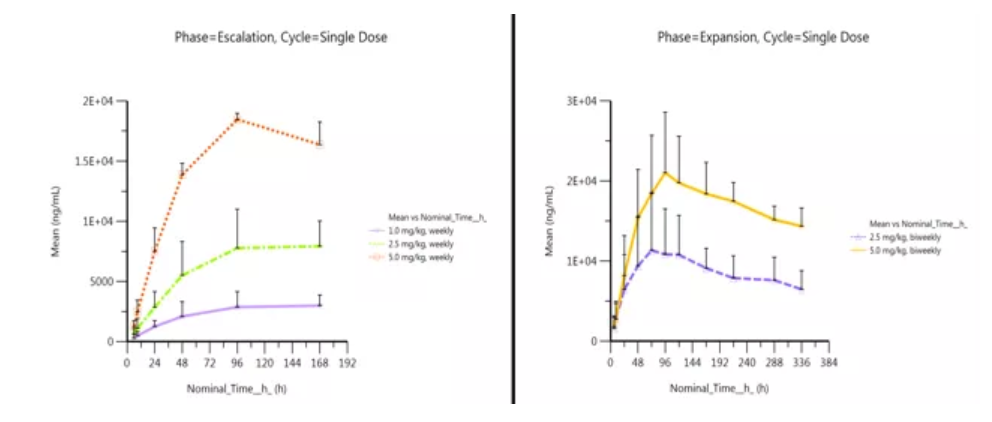
左:劑量遞增階段患者單次QW給藥後血清中KN035的平均藥物濃度-線性時間曲線圖(Mean+SD)
右:劑量擴展階段患者單次Q2W給藥後血清中KN035的平均藥物濃度-線性時間曲線圖(Mean+SD)
結論
Envafolimab單藥在治療日本多種晚期實體瘤患者中安全性及耐受性良好,在所有劑量水平下均未觀察到DLT,未達到MTD,表現出令人期待的抗腫瘤活性和持續緩解。基於每2周用藥的PK數據,目前正在評估每4週固定劑量給藥這種較少頻率的給藥方案。
總體來看,Envafolimab (KN035)作為全球首個皮下注射抗PD-L1單域抗體,安全性及初步療效與其他公司靜脈給藥的同類產品結果一致,藥效強,維持時間長,臨床使用方便。鑑於理想的I期數據,Envafolimab目前正在國內開展一項MSI-H實體瘤Ⅱ期和一項膽道癌Ⅲ期的註冊性臨床研究。
熱門文章

請諮詢我們