恩維達®獲批兩周給藥方案,大幅提高患者用藥便捷性
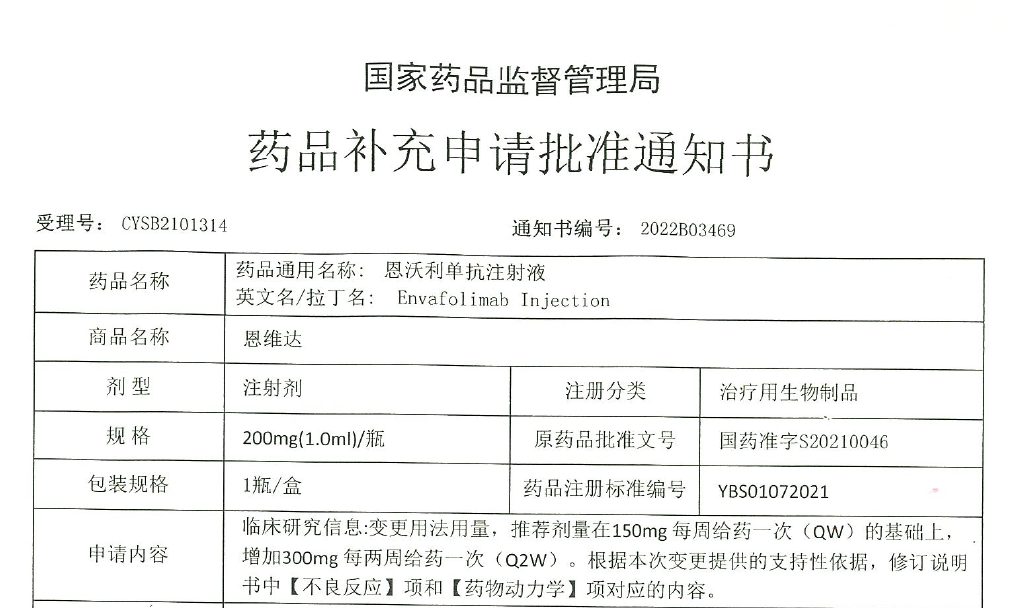
中國北京,2022年8月19日—思路迪醫藥(3D Medicines),宣佈其首個商業化產品--全球首款皮下注射PD-L1抑制劑恩維達®,“新增300mg每兩周給藥一次”的補充申請獲國家藥品監督管理局(NMPA)批准。此項批准主要是基於公司在中國、美國和日本的臨床藥理學數據。此次新的用法用量的獲批將大幅減少藥品使用頻率,提高患者用藥便捷性,給腫瘤患者更好的治療選擇。思路迪醫藥堅持以患者為中心的理念,不斷探索更優的給藥方案,踐行幫助腫瘤患者活得更久更好的美好願景。
本次新增的劑量用法方案,與此前恩維達®的推薦劑量及用法“150mg每週給藥一次”相比,有著相似的藥代謝動力學,安全性和有效性特徵。此次補充申請的獲批,可以在保證恩維達®臨床療效的前提下,給予患者更多的治療方案選擇。對於醫生來說,用藥方案更加靈活,可根據患者實際情況選擇單周給藥抑或雙周給藥,提高醫療資源的使用效率;對於患者而言,將提升藥物使用的便捷性,直接減少用藥和就醫頻率,顯著改善生活品質。
恩維達®是全球首個且唯一上市的皮下注射PD-1/PD-L1抗體藥物,也是中國首個獲批的泛瘤種適應症(MSI-H/dMMR)免疫治療藥物。恩維達®具有與進口PD-(L)1藥物相當的療效,且較同類藥物在安全性、便利性和依從性方面具有獨特優勢,患者無需進行長達30 分鐘以上的靜脈滴注,而是只需要30秒內完成皮下注射用藥,極大地提升了用藥體驗、降低了醫療成本。除臨床治療上的快捷與便利,恩維達®在療效上也得到了中國臨床腫瘤學會(CSCO)的認可,已進入《CSCO胃癌診療指南2022版》(Ⅰ級推薦,2A類證據)、《CSCO結直腸癌診療指南2022版》(Ⅱ級推薦,2A類證據)、《CSCO免疫檢查點抑制劑臨床應用指南2022版》(I級推薦,2A類證據)。恩維達®已在中國惠及超過10000名腫瘤患者,並正在開展超過15項單藥及藥物聯用的臨床試驗,其中在美國開展的治療軟組織肉瘤和在中國開展的治療膽管癌等研究已進入註冊/臨床III期,相信未來將繼續給患者帶來更多更優質的治療選擇。
關於恩維達®
恩維達®基於其獨特設計,在安全性、便利性、依從性方面具有優勢,患者無需進行靜脈滴注,同時有望降低醫療成本。目前在中國、美國和日本針對多個腫瘤適應症同步開展臨床試驗,多個適應症已進入註冊/Ⅲ期臨床。恩維達®已被美國FDA授予晚期膽道癌孤兒藥資格、軟組織肉瘤孤兒藥資格。2021年11月,恩維達®正式在中國率先獲批上市,適用於不可切除或轉移性微衛星高度不穩定(MSI-H)或錯配修復基因缺陷型(dMMR)的成人晚期實體瘤患者的治療,包括既往經過氟尿嘧啶類、奧沙利鉑和伊立替康治療後出現疾病進展的晚期結直腸癌患者以及既往治療後出現疾病進展且無滿意替代治療方案的其他晚期實體瘤患者。
關於思路迪醫藥(3D Medicines Inc.)
思路迪醫藥是一家進入商業化階段專注腫瘤治療領域的創新藥公司,秉承“幫助腫瘤患者活得更久更好”的願景,針對腫瘤治療慢病化趨勢開發新一代抗腫瘤藥物。公司產品線包括12款具有差異化臨床價值或全球領先的創新藥,其中8款已進入臨床開發或商業化階段,包括全球首個皮下注射PD-L1單域抗體新藥恩維達®已獲國家藥品監督管理局批准上市銷售;引進first-in-class多肽腫瘤疫苗3D189和GAS6/AXL抑制劑3D229已進入全球III期臨床研究;自主研發的多靶點激酶抑制劑3D011也進入了臨床開發階段,臨床前品種包括國際領先的雙抗CD3xPD-L1等。公司建立了完善的創新藥研發平臺,涵蓋腫瘤靶點驗證、藥物發現、生物標誌物開發以及臨床開發等。公司逾200人的國際化團隊,具有從藥物發現、臨床前研究、臨床開發、申報上市及商業化的成功經驗,多個適應症已獲得FDA及NMPA孤兒藥認證或優先審評。思路迪醫藥秉承以臨床價值為中心,為全球腫瘤患者開發更優的腫瘤治療藥物。
更多資訊請訪問:
http://www.3d-medicines.com
思路迪醫藥前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,於作出前瞻性陳述當日之後,無論是否出現新資料、未來事件或其他情況,我們並無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,並理解我們的實際未來業績或表現可能與預期有重大差異。本文內所有關於或引用的本公司及董事的陳述、觀點或意願乃本文章刊發日期作出,可能因未來發展而出現變動。
熱門文章

請諮詢我們